목적
목적
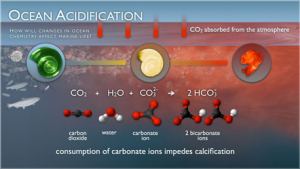
- 학생들은 이산화탄소의 용해 반응이 물을 생명체를 유지해주는 액체에서 위협하는 액체로 어떻게 바뀌는지 학습한다.
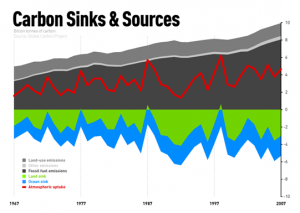
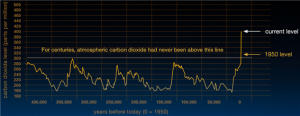
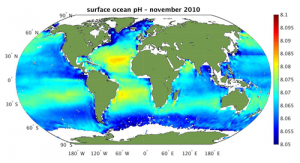
- 학생들은 CO2 증가가 지구 온난화를 야기할 뿐만 아니라 산성화로 인해 해양 생명체에도 영향을 끼친다는 것을 알 수 있다.
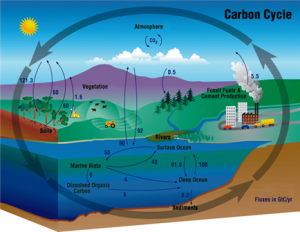
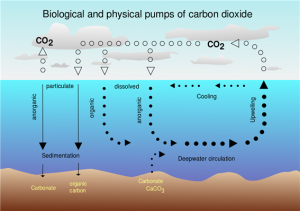
- 바다는 지구 온난화를 경감시키는데 기여를 하는 이산화탄소 흡수계의 역할을 하지만 이로 인해 바다 자체에도 엄청난 악영향을 가져온다.
- 학생들은 물의 온도에 따라 용해되는 CO2의 양이 다르다는 것을 알 수 있다.
 학습 목표
학습 목표
학생들은 아래의 것을 할 수 있게 된다.
- pH 값을 측정하여 물에 용해된 이산화탄소가 물의 화학적 성질을 중성에서 산성으로 변화시키는 것에 대해서 설명할 수 있다.
- 자연 현상에 대한 실험을 기반으로 대기의 이산화탄소의 양의 증가가 바다의 화학적 균형에 영향을 미치는 이유에 대해서 추론하여 설명할 수 있다.
- 첫 번째 활동에서 산성 용액에 열을 가함으로써 물에 용해된 이산화탄소의 양이 물의 온도에 따라 다르다는 것을 설명할 수 있다.
 평가
평가
- 학생들에게 유기물을 태우거나 인간이 숨을 내쉴 때 발생하는 기체가 무엇인지에 대해서 질문한다.
- 첫 번째 활동을 수행한다. 학생들은 물에 이산화탄소를 불어 넣어 물을 산성으로 변화시키는 방법에 대해 알 수 있다.
- 이산화탄소 수치가 지속적으로 증가하는 대기에 해양이 끊임없이 접촉하면 어떤 반응이 나타나는지 학생들에게 질문한다.
- 학생들에게 산성의 세기에 대해서 물어본다.
- 학생들에게 사이다나 탄산수를 상온에 두었던 일상 경험을 회상하게 하여 용해된 이산화탄소가 용액에서 다시 빠져나올 수도 있음에 대해서 질문한다.
- 대기와 해양의 온도가 모두 높아지게 되면 대기 중의 이산화탄소 백분율이 영향을 받는 과정에 대해서 학생들이 설명하도록 한다.
 준비물
준비물
준비물의 수는 실험을 수행하는 학생의 수에 맞게 준비되어야 한다. 준비물 한 세트:
- 증류수나 염분을 제거한 물
- 투명한 컵
- 빨대
- McCrumb가 만든 만능 pH 지시약과 그와 같은 pH 등급(활동 패키지에 해당하는 물품을 구입할 수 있다.)
- 대체품: 적양배추로 만든 pH 지시약
- 작은 가열기 혹은 난로
가열기는 물을 중성으로 만들기 위해서 두 번째 활동에서 필요한 물품이다. 안전을 위해서 해당 실험 수행 여부는 선생님이 결정하도록 한다.